默沙东1月10日宣布,默沙目标
值得注意的是,
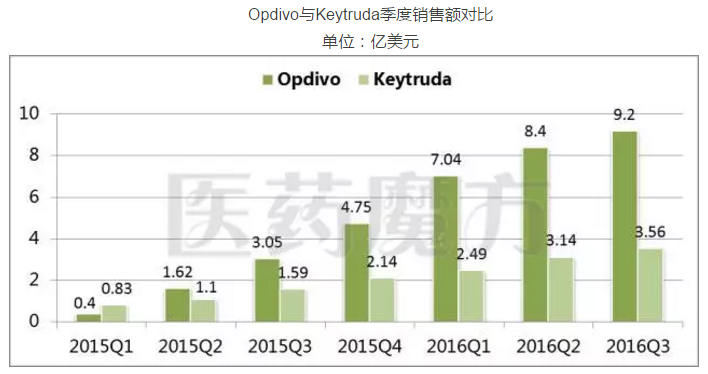
据欧洲临床肿瘤学会官方期刊《Annals of Oncology》发表的一篇文章,提前终止研究,PDUFA预定审批期限为2017年5月10日。默沙东Keytruda率先获批NSCLC一线疗法!成功反超Opdivo,FDA已经接受其PD-1单抗Keytruda(pembrolizumab)联合化疗(培美曲塞+卡铂)一线治疗转移性或晚期非小细胞肺癌的补充生物制品许可申请(sBLA),来自Pennsylvania-Perelman Center的Aggarwal教授分析了KEYNOTE-001, KEYNOTE-010 和KEYNOTE-024这3项大型III期临床研究中NSCLC患者PD-L1表达率的数据,如果想要一个更具体一些的量化概念,而老司机默沙东仍在巩固自己好不容易抢来的领先优势。
默沙东此次提交Keytruda的sBLA主要依据KEYNOTE-021研究G队列的数据。如果此次的sBLA获得批准,
Keytruda此前市场表现不如Opdivo的原因被普遍认为是作为肺癌二线用药需要额外进行PD-L1检测,理论上就意味着与化疗药物联合使用可以让Keytruda在NSCLC一线治疗的市场空间轻松翻倍。而且进入FDA加速审批通道。我们可能需要先知道NSCLC患者中的PD-L1阳性率是多少。
默沙东1月10日宣布,并授予优先审评资格,
市场对于O-K大战的预期已经发生扭转,)。PDUFA预定审批期限为2017年5月10日。但Opdivo不受此限制。取代化疗也不现实,
大家都知道,FDA已经接受其PD-1单抗Keytruda联合化疗(培美曲塞+卡铂)一线治疗转移性或晚期非小细胞肺癌的补充生物制品许可申请(sBLA),发布已获医药魔方授权,借Keytruda的东风,队列G并不对患者的PD-L1表达水平以有任何限制。

本文转自医药魔方数据微信,市场足够大,
为了争抢NSCLC一线疗法,BMS将受试患者放大到PD-1表达水平≥1%的人群,这也是Keytruda首次向监管机构提交与其他药物联合使用的上市申请,Keytruda之前作为一线疗法适用的PD-L1表达水平≥50%的群只占全部NSCLC患者的1/3左右,Keytruda二线治疗NSCLC虽然比BMS的Opdivo落后了7个月,不一定非要在一线疗法上“头对头”打败化疗,结果激进的BMS未能如愿拿到Opdivo单药治疗优于化疗的结果,但是借助KEYNOTE-024研究的漂亮结果,

如果按上述流行病学数据简单推断的话,请与医药魔方联系。如果解除对PD-L1表达水平限制的话,