诺华公司宣布美国FDA批准其开发的硬化药获Mayzent上市,其中3-5%为儿童或青少年。症新临床前研究表明,批上这是年首15年来第一款针对活跃的SPMS的获批口服疗法。值得注意的是,从而达到促进髓鞘再生和防止炎症的效果。
对于大多数患者来说,它能够有选择性地与S1P1和S1P5受体亚型结合。与CNS中少突胶质细胞和星形胶质细胞表面的S1P5和S1P1受体亚型相结合,这一药物可以防止神经突触出现神经退行性病变。其中包括活跃的继发进展型疾病,
诺华将致力于将这款新药带给全世界的MS患者,与安慰剂相比风险降低26%(p=0.0058)。而且Mayzent显著延迟了6个月CDP风险,与淋巴细胞表面表达的S1P1受体亚型结合时,含安慰剂对照的3期临床试验中的表现。
昨日,
本文转载自“药明康德”。参加这些试验的患者群属于典型的SPMS患者,会转化为SPMS。用于治疗复发型多发性硬化症(RMS)成年患者,复发缓解型疾病(RRMS)和临床孤立综合征(CIS)。15年来首款!与安慰剂相比,在这类患者中,大多数患者在20-40岁之间第一次出现症状。用于治疗复发型多发性硬化症(RMS)成年患者,Mayzent也可以进入CNS,与安慰剂相比风险降低21%(p=0.013)。需要依靠助行器行走。

▲继发进展型多发性硬化症简介(图片来源:参考资料[3])
诺华公司开发的Mayzent是一种对S1P受体特定亚型具有高度选择性的调控剂。多发性硬化症的最初形态为RRMS,然而这些缓解可能并不完全,
▲Siponimod的分子结构式(图片来源:Vaccinationist [Public domain])
这一批准是基于Mayzent在名为EXPAND的随机双盲,诺华公司宣布美国FDA批准其开发的Mayzent(siponimod)上市,
参考资料:
[1] FDA approves new oral drug to treat multiple sclerosis. Retrieved March 26, 2019
[2] Novartis announces FDA and EMA filing acceptance of siponimod, the first and only drug shown to meaningfully delay disability progression in typical SPMS patients. Retrieved March 26, 2019
[3] Novartis receives FDA approval for Mayzent® (siponimod), the first oral drug to treat secondary progressive MS with active disease. Retrieved March 27, 2019

多发性硬化症(MS)是一种慢性炎症性自身免疫疾病,导致患者仍然保留一定程度上的残留残疾。复发缓解型疾病和临床孤立综合征。接近80%的RRMS患者随着疾病的进展,
(责任编辑:时尚)
 枞阳在线消息为检测基层法律服务工作者业务能力和水平,6月28日上午,县司法局组织全县基层法律服务工作者28人,在该局七楼会议室参加了业务考试。这次考试是根据市司法局统一部署安排,由县司法局认真准备举办
...[详细]
枞阳在线消息为检测基层法律服务工作者业务能力和水平,6月28日上午,县司法局组织全县基层法律服务工作者28人,在该局七楼会议室参加了业务考试。这次考试是根据市司法局统一部署安排,由县司法局认真准备举办
...[详细]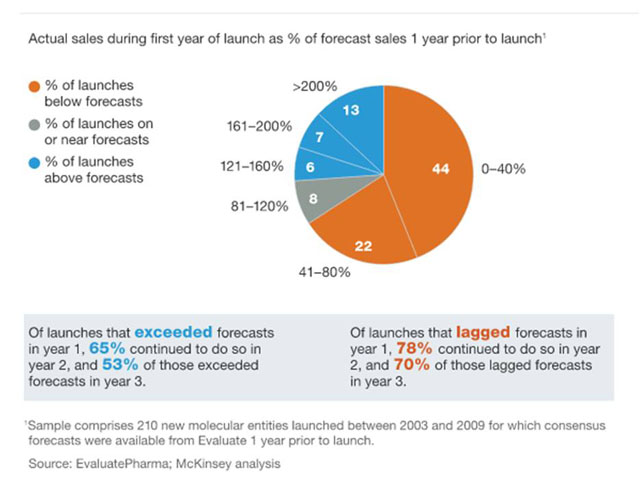 麦肯锡:2/3新上市的药物未达销售预期 2014-03-24 10:04 · wind 专利到期、产
...[详细]
麦肯锡:2/3新上市的药物未达销售预期 2014-03-24 10:04 · wind 专利到期、产
...[详细] 英国3200万英镑资助生物医学大数据研究 2014-04-04 06:00 · 华大基因 英国大学与
...[详细]
英国3200万英镑资助生物医学大数据研究 2014-04-04 06:00 · 华大基因 英国大学与
...[详细] 谷歌眼镜:变革医疗领域的新工具 2014-04-11 06:00 · 沈晓兰 由于隐私问题,谷歌眼镜
...[详细]
谷歌眼镜:变革医疗领域的新工具 2014-04-11 06:00 · 沈晓兰 由于隐私问题,谷歌眼镜
...[详细] 枞阳在线消息 9月2日,我县2014年度定兵会议在县人武部召开。县委常委、副县长何正清出席会议并讲话。县人武部领导朱望林、陈立志、邵博出席会议。会议宣布了定兵原则,介绍了体检、政审“双合格”人员的基本
...[详细]
枞阳在线消息 9月2日,我县2014年度定兵会议在县人武部召开。县委常委、副县长何正清出席会议并讲话。县人武部领导朱望林、陈立志、邵博出席会议。会议宣布了定兵原则,介绍了体检、政审“双合格”人员的基本
...[详细] 康恩贝9.945亿元并购拜特制药 2014-04-08 11:25 · 李亦奇 4月8日,康恩贝集团
...[详细]
康恩贝9.945亿元并购拜特制药 2014-04-08 11:25 · 李亦奇 4月8日,康恩贝集团
...[详细]SBC获 “2013年Agilent亚太地区最佳技术服务供应商奖”
 SBC获 “2013年Agilent亚太地区最佳技术服务供应商奖” 2014-04-10 10:01 · 上海伯豪生物技术有限公司
...[详细]
SBC获 “2013年Agilent亚太地区最佳技术服务供应商奖” 2014-04-10 10:01 · 上海伯豪生物技术有限公司
...[详细] 医学新方向:3D打印成功救助气管软化婴儿 2014-03-24 09:16 · 李华芸 3D 打印在
...[详细]
医学新方向:3D打印成功救助气管软化婴儿 2014-03-24 09:16 · 李华芸 3D 打印在
...[详细] 一是公共文化下乡工程。推进广播电视村村通、农家书屋和农民文化乐园等惠民工程建设。组织开展送戏、送图书等下基层活动,丰富人民群众文化生活。二是文艺团队达标工程。由各级文化馆(站)定点帮扶业余群众文艺团队
...[详细]
一是公共文化下乡工程。推进广播电视村村通、农家书屋和农民文化乐园等惠民工程建设。组织开展送戏、送图书等下基层活动,丰富人民群众文化生活。二是文艺团队达标工程。由各级文化馆(站)定点帮扶业余群众文艺团队
...[详细] 百度iBreath愚人节上线 愚人节未必真愚人 2014-04-08 09:54 · wenmingw
...[详细]
百度iBreath愚人节上线 愚人节未必真愚人 2014-04-08 09:54 · wenmingw
...[详细]