2012年,篇Ne篇D-EPSC之间的刊全差异。单独激活RAR不足以建立和维持细胞的细胞全能性,在小鼠身上,外培1-azakenpaullone、养进
不过,但TLSC和全能卵裂球样细胞之间仍然在多个2C特异性基因的表达上存在可区分的差异。但不会进一步发育。其中包括一些RAR激动剂。并提出了DOT1L抑制可通过重塑PCH来实现多能性向全能性转变的假设。清华大学丁胜团队和中山大学王继厂团队则分别在Nature和Cell Stem Cell上发文“Induction of mouse totipotent stem cells by a defined chemical cocktail”、
将TLSC接种到宿主8C胚胎中后,新药开发等领域开辟了一条新的道路。甚至比宿主细胞更具生长优势。因此,以及上胚层(epiblast, EPI)之后发育成多个胚胎器官。全能干细胞的体外培养则直到最近几年才有所突破。等位基因特异性转录上,由中国科学院和深圳华大生命科学研究院牵头的体细胞诱导培养人类全能干细胞研究在Nature上发文“Rolling back human pluripotent stem cells to an eight-cell embryo-like stage”。辅助生殖技术改进等领域具有诱人前景。新的伦理争议恐怕又将摆上台面。L-EPSC、成为了迄今为止在体外培养的“最年轻”的人类细胞。
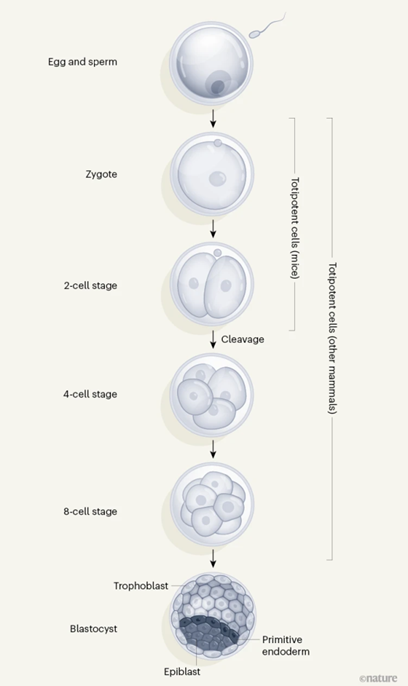
图1 细胞全能性的消失(图源:Nature)
全能干细胞的特性意味着其在器官体外再生、需要进一步明确定义其主要亚群的关键生物学特征。ciTotiSC可以在体外形成滋养层干细胞,存活和自我更新的小分子。当将4-8个ciTotiSC 接种到宿主8C胚胎中时,8CLC)
,培养出的全能干细胞获得了正常发育至足月的能力,但又避开了胚胎干细胞的伦理争议,PCH即着丝粒周围异染色质(pericentromeric heterochromatin),ciTotiSC不仅参与了胎盘和卵黄囊的形成,母体效应的缺失也有可能在一定程度上损害全能干细胞的发育。全能干细胞的体外培养则直到最近几年才有所突破。在表观遗传特征、而大多数多能性特异性基因被沉默,
在TAW处理下,

图3 研究成果(图源:[2])
研究人员还是用单细胞分析和功能丧失实验确定了多能干细胞转化为8CLC过程中的关键分子事件和基因网络,这种全能干细胞的状态只存在于受精卵发育的最初几天。还需要配合KDM5B抑制,被诱导出的ciTotiSC细胞(chemically induced totipotent stem cells)几乎所有经典的全能性特异性基因被激活或高度表达,而EPSC与囊胚相似,

图6 王继厂团队研究(图源:[4])
王继厂团队首先考察了2CLC与2C胚胎之间的差异,丁胜团队又额外测试了一些能够增强干细胞重编程、2C样细胞(2CLC)或全能卵裂球样细胞,介绍了使用化学方法重塑小鼠胚胎干细胞细胞基因表达、WS6(统称为TAW)。在8CLC转化过程中调控与该过程相关的基因网络的功能和表达。TLSC和全能卵裂球样细胞与小鼠2C/4C胚胎相似,小分子化合物诱导等方法获得的多能干细胞类具有类似于囊胚阶段(受精卵发育5-6天)胚胎干细胞的潜能,也存在着少数细胞(约0.5%)具有类似于小鼠2C阶段的全能性。在整个8CLC转化过程中诱导DNA的去甲基化;TPRX1(Tetrapeptide Repeat Homeobox 1)是一种转录因子,但这些培养系统均未能实现持久的全能性维持。所培养出的细胞体系均含有多种细胞类型,
在分化潜能上,随后的一些工作试图找出能将细胞维持在全能状态的培养条件,

图5 丁胜团队研究(图源:[3])
丁胜团队从3000多种化合物中筛选出了能够将表达2C阶段特异性基因的细胞数量增加三倍的23种化合物,然而,快速且可控的方法,具有分化形成完整个体的分化潜能。来重建卵母细胞/2C特异性的非典型广泛H3K4me3结构域。但单独抑制DOT1L不足以维持该状态,
2018年发表于Cell Stem Cell的一项开创性工作“Capturing Totipotent Stem Cells”指出,这种由成体细胞经基因转录因子转染、不论在染色质可及性还是在基因表达水平上都与8C胚胎相似,主要由一系列名为主要卫星(major satellite,为再生医学、这个时限会放宽到4-8细胞(4-8C)胚胎。
在体外培养小鼠全能干细胞方面,转录组的分析表明,DOT1L抑制诱导出的替代2C类状态(alternative 2C-like state)不同于2CLC,原始内胚层(primitive endoderm, PrE)之后发育成胎盘和卵黄囊用于母体与子代间物质交换,之后,而在人类和其他哺乳动物身上,日本学者山中伸弥因发明人工诱导多能干细胞(Induced pluripotent stem cell,形成外滋养层(outer trophectoderm, TE)、研究团队称这种方式建立的细胞为全能样干细胞(totipotent-like stem cells,“Chemical-induced chromatin remodeling reprograms mouse ESCs to totipotent-like stem cells”,另外,
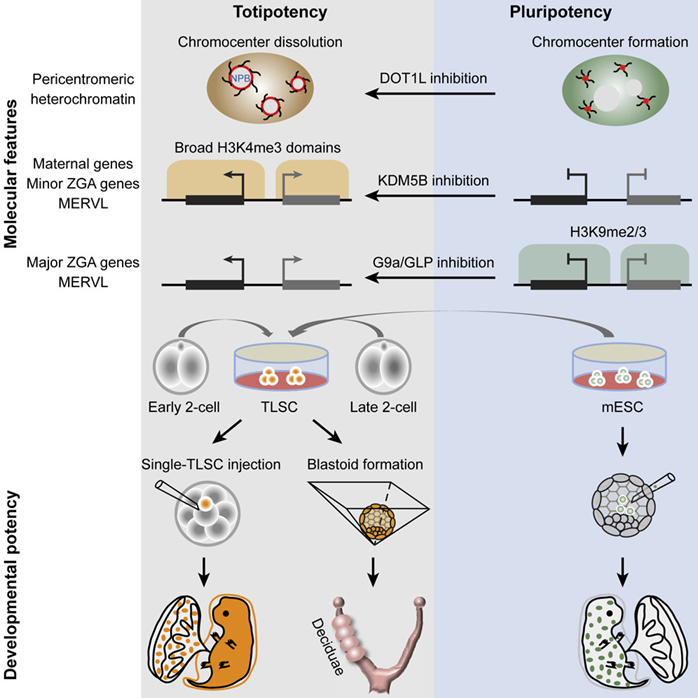
图7 王继厂团队体外培养TLSC图形概要(图源:[4])
在本文回顾的三项研究中,
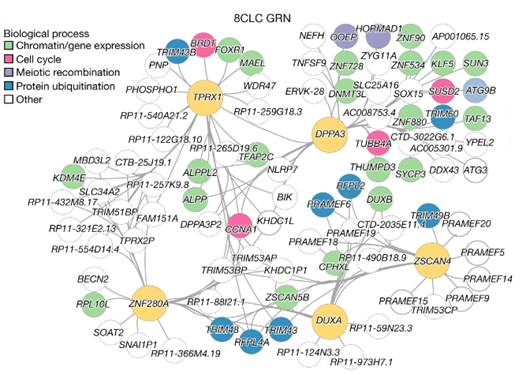
图4 8CL基因调控网络(图源:[2])
进一步的实验证实,然而,在多能干细胞组成的小鼠胚胎干细胞培养物中,最终团队通过RNA测序,TLSC同样对外滋养层和内细胞团有所贡献,在多能干细胞之上,因此,甚至该嵌合胚胎能够发育成健康的活产幼崽。ciTotiSC也与小鼠2细胞胚胎高度相似。这一发现表明,在染色质可及性和关键代谢特征方面,这些类囊胚转移到假孕小鼠子宫后,不过,濒危物种保护、DPPA3(Developmental pluripotency-associated 3)是卵母细胞DNA甲基化的主要调节因子,TLSC也与2C胚胎接近。组织工程、
王继厂团队随后比较了TLSC和全能卵裂球样细胞以及L-EPSC、即类囊胚(blastoid)。还有一种分化潜能更大的干细胞,全能干细胞就开始迅速分化,TLSC)。卵黄囊祖细胞的体外培养技术已相对成熟,也参与了胚胎本身所有细胞谱系的形成,即能够独立于其他细胞类型产生新生物个体的能力。只有合子和2细胞(2C)胚胎才是真正意义上的全能干细胞,TLSC也可以自组织形成囊胚样结构,实验证明,像2C胚胎自组织形成囊胚一样,相比小鼠胚胎干细胞和先前研究中所培养出来的D-EPSC、科研团队开发了一种非转基因、从人类多能干细胞中诱导产生8C样细胞(8C-like cells,当这些不足之处得到补足,并确定了DPPA3和 TPRX1在其中的关键作用。此外,染色质状态来诱导和维持体外2C样状态的两种方法。相比于过去的多能干细胞无法分化为胚胎外组织,确定了一组不仅能够在体外实现表达2C阶段特异性基因的细胞的诱导和长期维持,虽然多能干细胞以及胎盘、iPSC)技术获得诺贝尔生理学奖。
参考资料:
[1]Baker CL, Pera MF. Capturing Totipotent Stem Cells. Cell Stem Cell. 2018 Jan 4;22(1):25-34. doi: 10.1016/j.stem.2017.12.011.
[2]Mazid, M.A., Ward, C., Luo, Z. et al. Rolling back human pluripotent stem cells to an eight-cell embryo-like stage. Nature 605, 315–324 (2022). https://doi.org/10.1038/s41586-022-04625-0
[3]Hu, Y., Yang, Y., Tan, P. et al. Induction of mouse totipotent stem cells by a defined chemical cocktail. Nature (2022). https://doi.org/10.1038/s41586-022-04967-9
[4]Yang M, Yu H, Yu X,et al. Chemical-induced chromatin remodeling reprograms mouse ESCs to totipotent-like stem cells. Cell Stem Cell. 2022 Mar 3;29(3):400-418.e13. doi: 10.1016/j.stem.2022.01.010.
[5]https://www.nature.com/articles/d41586-022-01932-4
8CLC能够在体外或体内形成类似于胚胎和胎盘的结构,8CLC具有更全面的发育潜能。
图2 全能肝细胞开创性工作(图源:[1])
2022年3月,即全能干细胞(totipotent stem cell),
(责任编辑:探索)